Patentrecht
EU-Pharmapaket: Mehr Transparenz bei Arzneimittelpatenten
Mit dem Pharmapaket hat die Europäische Kommission am 26. April 2023 Vorschläge für die umfassendste Reform des Arzneimittelrechts auf EU-Ebene seit 20 Jahren vorgelegt. Darin enthalten sind auch neue Regeln für Pharmapatente. Unter anderem sollen mehr Transparenz bei Studiendaten und eine Verkürzung der Schutzfristen für mehr Innovation und eine schnellere Verfügbarkeit von Generika sorgen. Die Industrie befürchtet jedoch, dass sich die Vorschläge als zweischneidiges Schwert entpuppen könnten.
Das EU-Pharmapaket: Umfassendste Reform des Arzneimittelrechts seit 20 Jahren
Die EU-Kommission hat sich mit ihrem Reformvorschlag viel vorgenommen: Besserer und früherer Zugang zu Arzneimitteln, Abbau bürokratischer Hürden, ein Medikamentenbinnenmarkt mit zentraler Steuerung, mehr Innovation in der europäischen Pharmaindustrie und mehr Nachhaltigkeit sind die Kernziele. Umgesetzt werden sollen diese mit einer neuen Verordnung und einer neuen Richtlinie.1)
 Besserer und früherer Zugang zu Arzneimitteln, Abbau bürokratischer Hürden und ein Medikamentenbinnenmarkt: Das EU-Pharmapaket ist die größte Reform des europäischen Arzneimittelrechts in 20 Jahren. © freestocks/Unsplash
Besserer und früherer Zugang zu Arzneimitteln, Abbau bürokratischer Hürden und ein Medikamentenbinnenmarkt: Das EU-Pharmapaket ist die größte Reform des europäischen Arzneimittelrechts in 20 Jahren. © freestocks/UnsplashDie neue Verordnung soll die Verordnungen (EG) 726/2004 und (EG) 141/2000 (Arzneimittel für seltene Leiden) ersetzen. Bestimmte Regelungen der Verordnung (EG) 1901/2006 (Kinderarzneimittel) werden integriert. Sie konzentriert sich vor allem auf Regelungen für die innovativsten Arzneimittel und legt die Voraussetzungen für ein koordiniertes Management von kritischen Engpässen und die Versorgungssicherheit mit wichtigen Arzneimitteln fest. Darüber hinaus enthält sie Regelungen zur Stärkung der Europäischen Arzneimittelagentur (EMA).2)
Der Entwurf der neuen EU-Richtlinie soll die bisherigen Richtlinien 2001/83/EG und 2009/35/EG ersetzen und integriert auch Aspekte der Kinderarzneimittel-Verordnung 1901/2006. Er legt Anforderungen an die Zulassung, Überwachung, Kennzeichnung und den rechtlichen Schutz, das Inverkehrbringen und andere regulatorische Verfahren für alle auf EU- und nationaler Ebene zugelassenen Arzneimittel fest.3)
Neuregelungen bei Pharmapatenten: Transparenz steht im Vordergrund
 Studiendaten sollen künftig transparenter werden, um die Forschung zu beschleunigen. © National Cancer Institute/Unsplash
Studiendaten sollen künftig transparenter werden, um die Forschung zu beschleunigen. © National Cancer Institute/UnsplashEin zentrales Ziel der Reform im Bereich der Pharmapatente ist es, Generika- und Biosimilar-Herstellern einen schnelleren Markteintritt zu ermöglichen. Damit könnte zum Beispiel Lieferengpässen bei Arzneimitteln besser vorgebeugt werden. Künftig wird es daher mehr Transparenz bei klinischen Daten und Forschungsanreize zu wichtigen Themen geben: Die Dauer des Unterlagenschutzes wird verkürzt und die „Bolar-Exemption“ – die Möglichkeit von Generikaherstellern, bereits während noch bestehenden Patentschutzes an Nachahmerprodukten zu forschen - ausgeweitet.
Grundsätzlich streben die europäischen Behörden eine bessere Zugänglichkeit von Studiendaten an. Dies ist sowohl für die weltweite Forschung als auch für die Patientinnen und Patienten wichtig, die so z. B. vor Nebenwirkungen geschützt werden, die bereits in einer früheren Studie aufgetreten sind. Darüber hinaus sollen Anreize für die Forschung zu Seltenen Krankheiten, Kinderarzneimitteln und Antibiotika durch erweiterte Schutzzertifikate geschaffen werden.
Unterlagenschutz wird verkürzt
Pharmaunternehmen investieren oft Milliarden in Forschung und Klinische Studien. Deshalb gewährt das Arzneimittelrecht den Herstellern neuer Medikamente Unterlagenschutz und Vermarktungsschutz bzw. Marktexklusivität. Der Unterlagenschutz sichert dem Innovator für einen bestimmten Zeitraum den exklusiven Zugang zu seinen Studiendaten. Nach Ablauf dieser Frist müssen die Daten veröffentlicht werden, damit Generikahersteller darauf zugreifen und eigene Produkte entwickeln können. Bisher betrug die Dauer dieses Datenschutzes acht Jahre. Mit der neuen Regelung soll sie nun auf sechs Jahre verkürzt werden, die jedoch verlängert werden können, wenn der Innovator bestimmte Voraussetzungen erfüllt.
Zusätzlich gibt es eine Marktexklusivität von zwei Jahren nach Ablauf des Unterlagenschutzes, in der nur der Innovator sein Medikament verkaufen darf. Diese Frist bleibt unverändert. Generikahersteller dürfen nach Ablauf des Unterlagenschutzes also bereits entwickeln, aber erst nach Ablauf von zwei Jahren ein eigenes Produkt auf den Markt bringen. Das bedeutet, dass der Hersteller des Originalpräparats den Markt bisher mindestens zehn Jahre für sich hatte, jetzt aber nur noch acht Jahre.
Leichterer Marktzugang für Generika und Biosimilars
Die Entwicklung und Zulassung von Generika und Biosimilars soll insgesamt erleichtert werden. Hersteller, die ein Nachahmerprodukt zu einem bereits zugelassenen Arzneimittel auf den Markt bringen wollen, müssen künftig weniger Nachweise erbringen. Auch die sogenannte Bolar-Ausnahme wird erweitert, die es erlaubt, trotz bestehender Patente oder ergänzender Schutzzertifikate, Generika auf Grundlage des Originalprodukts zu entwickeln. Sie ist nun präziser formuliert und schließt auch Zulieferer und Dienstleister ein. Darüber hinaus gibt es Anreize und Erleichterungen, wenn sich neue Anwendungsgebiete für ein bereits zugelassenes Arzneimittel ergeben. Ziel ist es, Patientinnen und Patienten einen schnelleren Zugang zu neuen Therapien zu ermöglichen.
Anreize für besonders relevante Medikamente durch Verlängerung des Patentschutzes
Arzneimittel, die für die öffentliche Gesundheit besonders relevant sind (High Unmet Medical Needs), sollen durch einen längeren Schutz gefördert werden. Der Schutz kann bei Vorliegen eines besonderen öffentlichen Interesses auf bis zu zwölf Jahre verlängert werden, was ein Jahr länger ist als bisher. Anreize gibt es insbesondere auch für Orphan Drugs, für die die Marktexklusivität auf maximal 13 Jahre verlängert werden kann. Enthält ein Zulassungsantrag die Ergebnisse aller Studien, die im Einklang mit einem gebilligten pädiatrischen Prüfkonzept durchgeführt wurden, gibt es sechs Monate mehr.
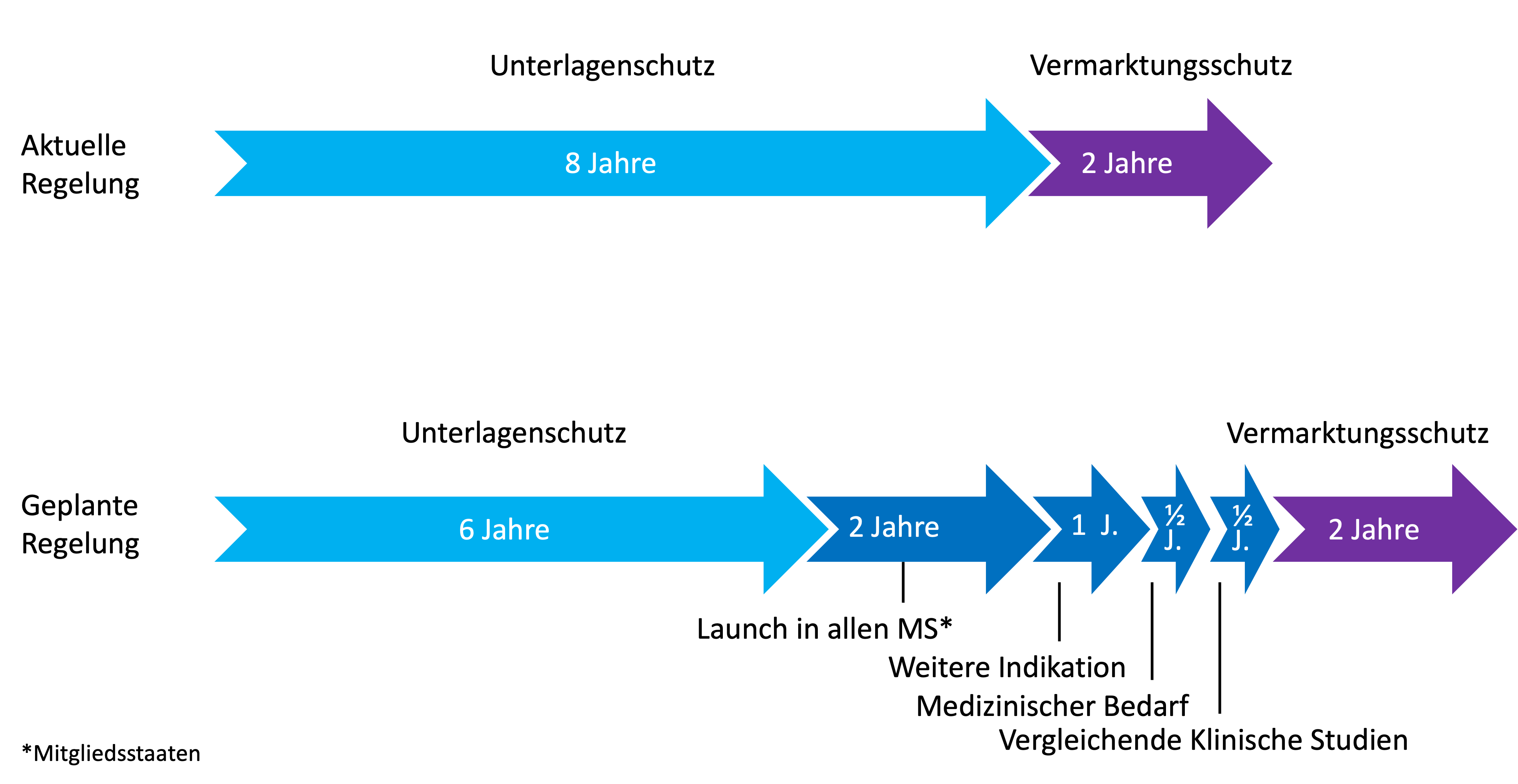 Die geplanten Änderungen bei den Fristen von Unterlagenschutz und Vermarktungsschutz des EU-Pharmapakets. © Dr. Anja Segschneider
Die geplanten Änderungen bei den Fristen von Unterlagenschutz und Vermarktungsschutz des EU-Pharmapakets. © Dr. Anja Segschneider
Gutscheinsystem mit Anreizen für Antibiotikaentwicklung
Da Antibiotikaresistenzen ein immer größeres Problem darstellen, werden ähnliche Anreize für die Entwicklung neuer Antibiotika durch die Verlängerung des Patentschutzes geschaffen. Dazu wird ein „Gutscheinsystem“ eingeführt. Dieses belohnt Entwickler innovativer Antibiotika mit übertragbaren Schutzgutscheinen. Diese verlängern den Unterlagenschutz um ein Jahr. Die Entwickler können die Gutscheine für ihre eigenen Produkte verwenden, auf andere Arzneimittel anwenden oder an Dritte verkaufen. Die Anzahl der Gutscheine ist begrenzt, um die Belastung der Gesundheitssysteme in Grenzen zu halten.
Zwangslizenzen
Zwangslizenzen für besonders wichtige Medikamente waren ein großes Thema während der Corona-Pandemie. Diskutiert wurde unter anderem der TRIPS-Waiver, ein Antrag Südafrikas und Indiens bei der WTO, den Schutz des geistigen Eigentums an COVID-19-Impfstoffen, Therapeutika, Diagnostika und medizinischen Geräten (kurz: COVID-19-Technologien) vorübergehend auszusetzen. Um künftig mehr Klarheit über das Vorgehen in solchen Notfällen zu schaffen, soll das EU-Pharmapaket nun explizit regeln, in welchen Fällen, für welche Dauer (Notfälle) und zu welchen Bedingungen (finanzieller Ausgleich) Unternehmen zu solchen Zwangslizenzen verpflichtet werden können.
Neue Regeln für Pharmapatente: Fluch oder Segen für Innovationen?
Das kürzlich vorgestellte Pharmapaket der EU soll Innovationen im Pharmasektor fördern und Medikamentenengpässe verhindern. Dabei setzt die Kommission vor allem auf mehr Transparenz: Forschenden soll der Zugang zu Daten erleichtert werden, was im Idealfall zu einer schnelleren Entwicklung von Medikamenten führt. Davon könnten vor allem Generikahersteller profitieren, die für eine größere Auswahl an verfügbaren Medikamenten sorgen. Allerdings gibt es auch Bedenken, vor allem aus der Industrie: Ein zu freizügiger Umgang mit Daten könnte Investoren abschrecken und den EU-Markt weniger attraktiv machen. Zudem wird befürchtet, dass die internationale Konkurrenz, etwa aus China, schneller zum europäischen Forschungsstand aufschließen könnten.
Wann und in welcher Form die Vorschläge der Kommission tatsächlich umgesetzt werden, ist angesichts dieser kontroversen Diskussion ungewiss. Derzeit durchlaufen sie zunächst das EU-Gesetzgebungsverfahren. Das Europäische Parlament und der Rat werden die Vorschläge prüfen - und möglicherweise noch ändern.